 | ||
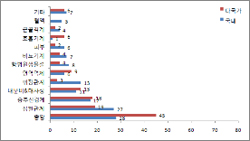
| ^^^▲ 임상시험 치료영역별 승인건수^^^ | ||
3/4분기 식약청이 승인한 의약품 임상시험 현황에 따르면 임상시험 치료영역별로는 종양분야가 73건(26.94%), 심혈관계(46건, 16.97%), 중추신경계 질환(35건, 12.92%) 의약품의 임상시험이 전체의 2/3 가량을 차지했다.
이는 전 세계적인 신약개발 R&D 추세와 국내 질병의 선진국화에 대한 결과반영이라고 식약청은 설명하고 있다.
신청 제약사별로는 한미약품 10건(3.69%), 보령제약 8건(2.95%)을 비롯 한국노바티스(12건 4.43%), 한국화이자제약(12건, 4.43%), 한국노바티스(12건, 4.43%), 바이엘코리아(11건, 4.06%), 한국와이어스(10건, 3.69%), 퀸타일즈트랜스내셔널코리아(10건, 3.69%), 한국비엠에스제약(9건, 3.32%), 글락소스미스클라인(7건, 2.58%), 서울대병원(7건, 2.58%), 연세대신촌세브란스병원(7건, 2.58%) 등 상위 11개사가 전체 임상시험의 38%를 차지했다.
국내 임상시험은 한미약품(10건), 다국가 임상시험은 한국노바티스(12건)가 1위를 점유했다.
9월말 현재 국내 임상시험실시기관은 총 132개 기관으로, 이중 서울대병원, 삼성서울병원, 서울아산병원, 연세대신촌세브란스병원, 서울성모병원등 빅5 종합대형 병원이 임상시험을 가장 많이 실시하는 것으로 조사됐다.
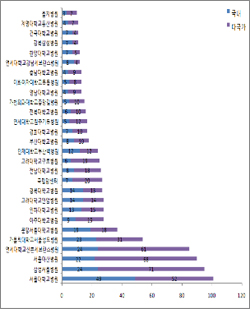 | ||
| ^^^▲ 실시기관별 임상시험건수^^^ | ||
국내 임상시험은 서울대병원(49건), 다국가 임상시험은 삼성서울병원(71건)에서 많이 수행했다.
특히 다국가 초기 임상시험은 삼성서울병원(25건, 51.02%), 연세대신촌세브란스병원(23건, 46.94%), 서울아산병원(23건, 46.94%), 서울대병원(15건, 30.61%), 서울성모병원(8건,16.33%) 등 빅5 종합병원뿐 아니라 국립암센터(8건, 16.33%)도 5위권에 포함돼 항암제 임상시험 비중이 높다는 것을 알 수 있다.
임상시험은 국내 임상시험(140건)이 다국가(Multinational) 임상시험(131건) 보다 약간 앞섰고, 임상시험 단계별로는 3상이 96건(35%)로 가장 많았으며, 1상 62건(23%), 2상 55건(20%), 연구자 임상시험 52건(19%) 등의 순으로 나타났다.
또한, 3분기에는 선진국에서 새로운 임상시험법으로 각광받고 있는 0상 임상시험도 제한된 조건으로 1건 승인되었다.
0상 임상시험은 신약개발을 할 때 임상시험 성공률을 높이기 위하여 정식 임상시험(1·2·3·4상) 이전에 소용량의 의약품으로 인체 내 약리학적 특성을 탐색하는 임상시험법이다.
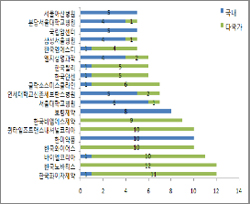 | ||
| ^^^▲ 국내-다국가 임상시험 신청자 현황^^^ | ||
이는 새로 도입된 전자민원창구가 국내 임상시험을 적극 지원하고 있는 데 따른 것으로 풀이된다.
식약청은 임상시험 피험자 보호 강화에 대해 "임상시험의 인프라 구축과 함께 임상시험에서 중요한 분야가 피험자의 보호인 만큼 이들의 인식과 체계적인 임상시험 관리시스템을 더욱 강화할 계획"이라고 밝혔다.

