식품의약품안전처는 허가·신고된 의약품의 유효기간(5년)을 품목별로 부여해 안전성과 효과성을 주기적으로 확보하고 효율적으로 관리하기 위한 ‘의약품 품목갱신 제도’의 제2주기(’23~’27) 운영 방안을 공개했다. 의약품 품목갱신 제도는 지난 2018년부터 본격 시행됐으며 5년 주기로 ▲안전관리자료 ▲외국사용현황 ▲품질관리자료 ▲제조·수입실적 등을 다시 검토하는 제도다. 단, 원료의약품·수출용의약품은 제외된다.
이번 운영 방안은 제1주기(’18~’22) 운영 결과와 ‘의약품 품목갱신 민·관 협의체’에서 논의된 의견을 토대로 마련했다.
제2주기에 가장 먼저 적용되는 2023년 갱신 대상 품목은 유효기간 만료 6개월 전인 올해 7월 이전에 갱신을 신청해야 한다. 식약처는 업계의 원활한 준비를 위해 ‘의약품의 품목갱신 업무 민원인을 위한 가이드라인’에도 반영해 안내할 예정이다.
제2주기 방안의 주요 내용은 ▲모든 전문의약품 부작용 분석‧평가자료 제출 ▲유효성 인정 범위 및 검토 절차 개선 ▲제품 품질평가 자료를 제조‧수입자 준수사항과 일치 ▲표시기재 확인·관리 강화 ▲제조원별·포장단위별 제조·수입실적 세부 검토 등이다.
안전관리책임자의 부작용 분석‧평가 자료는 그간 한국의약품안전관리원에 보고한 자료가 없는 경우 제출했으나, 앞으로는 규정을 개정해 모든 전문의약품에 대해 제출받아 심사할 계획이다.
또한유효성 입증자료로서 기존에는 주요 국가 허가사항 또는 허가 규정에 적합한 임상시험자료만 인정했으나 제2주기부터는 인정 범위를 임상 연구문헌(범주 1, 2)까지 확대한다.
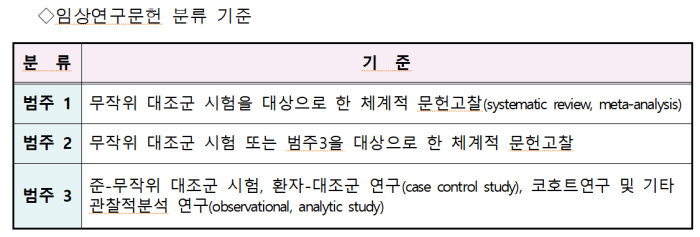
특히 희귀의약품 등에 대해서는 유효성을 입증하기 위해 제출할 수 있는 자료의 범위를 범주 3의 임상 연구문헌 또는 의학회 추천 교과서·임상진료지침까지 인정한다.
아울러 그간 제품 품질평가 자료는 현행 ‘의약품 등의 안전에 관한 규칙(총리령)’에 따른 6개 항목에 관한 자료를 제출해 왔다. 그러나 앞으로는 규정을 개정해 의약품실사상호협력기구(PIC/S) 기준이 적용된 ‘의약품 제조 및 품질관리에 관한 규정(식약처 고시)’에서 정하고 있는 12개 항목에 관한 자료를 제출받아 심사할 계획이다.
표시기재 자료는 그간 ‘약사법’에 따른 의무 표시기재 사항만을 검토했으나, 앞으로는 허가사항과의 일치 여부까지 확인해 소비자 대상 제공 정보를 더욱 철저하게 확인·관리한다.
또 제조‧수입실적은 그동안 품목별 실적 유무만을 확인했으나 앞으로는 규정을 개정해 동일한 품목 내 제조원별, 포장단위별 실제 제조‧수입 제품을 세부적으로 확인해 국내 유통 품목을 보다 효율적으로 관리할 계획이다.
한편 2023년 1월 1일부터는 본부에서 훈련된 역량 있는 심사원들이 각 지방청으로 배치돼 지방청 관할 허가·신고 품목에 대해 갱신 심사해 기관별 역량과 환경을 지속적으로 확보·개선할 계획이다.
식약처는 2020년 10월부터 의약품 품목갱신 심사의 전문성을 높이고 본부와 지방청의 심사 일관성을 유지하기 위해 본부와 지방청 소속 갱신 심사원들이 식약처 본부(오송)에서 지방청 허가·신고 품목을 포함한 모든 갱신 대상 의약품을 일괄 심사했다.
식약처는 의약품 품목갱신 제도 제2주기 시행으로 유통·판매 중인 의약품에 대한 최신의 안전성과 효과성을 주기적 확보함으로써 국내 의약품 안전관리 수준 향상과 국민 건강 보호에 도움이 될 것으로 기대하는 한편 앞으로도 규제과학 전문성을 바탕으로 의약품 품목갱신 제도를 지속적으로 개선할 방침이다.

