식품의약품안전처는 제조단위(Batch) 개념을 탈피한 연속제조 등 첨단기술을 적용한 의약품의 상용화를 지원하고, 국제적 수준의 심사체계를 마련하기 위해 정부와 업계로 구성된 ‘첨단의약품 혁신성장 지원 품질소통협의체’ 1차 회의를 7일 화상회의 방식으로 개최한다.
이번 회의에서는 3개분과의 주요 추진과제에 대해 논의한다.
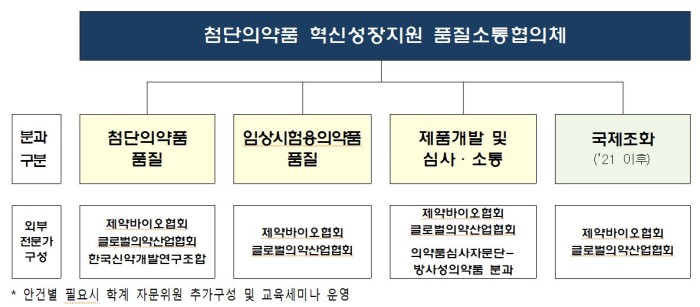
우선, 첨단의약품 품질 분과에서는 사물인터넷(IoT)을 활용한 실시간 품질관리 등 연속제조 시 완제품시험 면제 대상과 조건을 명확화하는 역할을 수행한다.
또한 임상시험용의약품 품질 분과는 임상시험 단계별‧변경수준별 차등심사 방안 마련 등 유익성·위해성에 기반해 임상시험 품질심사를 개선한다.
제품개발 및 심사·소통 분과는 ▲의약품 불순물 유전독성 시뮬레이션 평가 사례집 개정과 함께 ▲방사성의약품 맞춤형 품질 가이드라인 ▲마이크로니들을 이용한 의약품 개발 시 고려사항 등을 마련한다.
식약처는 제약 현장의 전문가가 참여하는 이번 협의체 운영을 통해 국제적 수준의 품질심사 체계가 마련돼 첨단기술이 접목된 의약품 출시를 앞당길 수 있을 것으로 전망했다. 아울러 협의체의 전문가 구성이 확대될 수 있도록 참여를 원하는 전문가는 식품의약품안전평가원 소화계약품과(043-719-3103, duri4209@korea.kr)로 연락해 줄 것을 당부했다.

