 | ||
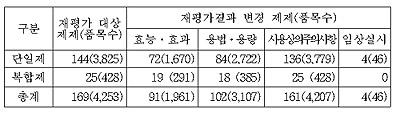
식약청에 따르면 재평가 대상 항생제 4,253개 품목(단일제 3,825품목, 복합제 428품목) 중 1,961품목(단일제 1,670, 복합제 291)에 대해서는 효능.효과를, 3,107 품목(단일제 2,722, 복합제 385)에 대해서는 용법.용량, 4,207품목(단일제 3,779, 복합제 428)에 대해서는 사용상의 주의사항을 각각 조정키로 했다.
이에따라 해당업체의 경우 1개월 이내에 이번 허가사항을 변경하고 해당품목을 유통중인 도매상, 병‧의원, 약국 등에 변경된 정보를 전달해야 한다.
그러나 장기간 사용경험에 따라 유용성은 인정되나, 추가로 안전성.유효성의 확인을 위해 최신 임상시험 자료가 필요한 4개성분 제제 46품목에 대하여는 국내임상을 실시한후 최종 평가를 내리기로 했다고 식약청은 밝혔다.
식약청이 의약품 안전관리 대책의 일환으로 지난 75년부터 실시해온 의약품재평가제도는 이미 허가된 의약품의 안전성・유효성을 최신 의약학적 수준에서 재평가해 보다 안전하고 우수의약품 제조.공급을 목적으로 한다.
이미 75년부터 2004년까지 284개 약효군 2만7,259품목에 대하여 재평가를 완료했다.
식약청은 내년에는 대사성의약품, 인공관류용제, 비타민제제, 자양강장변질제 등 20개 약효군 4,873 품목에 대한 재평가를 실시할 예정이라고 설명했다.

