 | ||
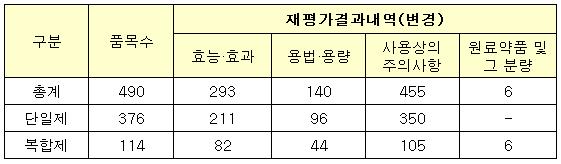
식약청이 발표한 재평가 결과에 따르면 490개 품목중 293개 품목에 대해서는 효능·효과를, 140개 품목에 대해서는 용법·용량을, 455개 품목에 대해서는 사용상의주의사항을 각각 변경토록 조치했다.<표 참조>
이번 재평가 결과에 따라 해당업소에서는 공시일로부터 1개월 이내에 변경사항을 품목허가증(신고수리필증)에 자사가 기재하여야 한다.
또한 제품의 첨부문서 등에 대하여는 허가사항 변경일 이전 제조된 제품은 기존의 제품설명서를 첨부할 수 있되, 변경일자 이후 출고되는 모든 제품은 별도의 변경내용을 추가 첨부해야 유통이 가능하다.
이와함께 당해 품목 공급업소(도매상, 병 의원 및 약국 등)에 정보전달 및 홈페이지 게재 등 "의약품등안전성정보의효율적전파를위한지침(의관 제65623-2469호(2003.11.27.))"에 의거 조치해야 한다.
 | ||
한편 식약청은 의약품 안전관리 대책의 일환으로 이미 허가된 의약품의 안전성·유효성을 최신의 의약학적 수준에서 재평가, 보다 안전하고 우수한 의약품을 제조·공급하고 의약품의 사용에 적정을 기하기 위해 지난 75년부터 의약품 재평가를 실시하고 있으며 2002년까지 271개 약효군, 22,612개 품목에 대하여 재평가를 실시한 바 있다.

